
Глава пятая. Содержание растений в аквариуме
Вода
Химические свойства воды
Жесткость воды и ее определение. В природной воде всегда присутствуют соли. От содержания солей кальция и магния зависит ее жесткость. Если солей много, вода называется жесткой, если мало,— мягкой. Различают жесткость воды временную и общую. Временная зависит от содержания в воде бикарбоната кальция Са(НСО3) и бикарбоната магния Мg(НСО3)2. Простым кипячением эти соли разрушаются, выпадают в осадок и жесткость воды значительно понижается. Этот осадок мы можем видеть на дне и стенках чайника, в котором часто кипятим воду. Если же вода содержит сульфаты и хлориды кальция и магния, жесткость ее называется постоянной и может быть устранена только дистилляцией или химическим путем. Общая жесткость воды равна сумме временной и постоянной жесткости. В СССР жесткость воды выражают суммой миллиграмм-эквивалентов ионов кальция и магния, содержащихся в 1 л воды; 1 м•экв жесткости отвечает содержанию 20,04 мг/л Са или 12,16 мг/л Mg.
В других странах жесткость воды измеряется в градусах жесткости: немецких: 1°=1 г СаО в 100000 г воды, или 10 мг СаО в 1 л воды; английских: 1 гран (0,0648 г) СаСО3 в 1 галлоне (4,546 л) воды = 1 г СаСО3 в 70000 г воды, или 10 мг СаСО3 в 0,7 л воды; французских: 1°=1 г СаСО3 в 100000 г воды, или 10 мг СаСО3 в 1 л воды; американских: 1° = 1 г СаСО3 в 10000 г воды, или 1 мг СаСО3 в 1 л воды. В аквариумной практике наиболее удобно выражать жесткость воды в русских и немецких градусах (H°=DgH). Сравнение единиц измерения жесткости воды приведено в табл. 4, 5.
| Жесткость, мг•экв/л | Жесткость, выраженная в градусах по шкалам | |||
| русской, немецкой | французской | английской | американской | |
| 1 | 2,804 | 5,005 | 3,511 | 50,045 |
| 0,35663 | 1 | 1,7848 | 1,2521 | 17,847 |
| 0,19982 | 0,5603 | 1 | 0,7015 | 10 |
| 0,28483 | 0,7987 | 1,4255 | 1 | 14,253 |
| 0,01998 | 0,0560 | 0,1 | 0,0702 | 1 |
Анализ воды по степени жесткости может быть определен лабораторным путем. Лабораторный способ определения содержания кальция и магния в воде наиболее совершенный, так как анализ проводится современным оборудованием, в надлежащих условиях и специалистами. Воду для анализа следует брать со средней глубины аквариума после тщательного перемешивания ее продувом воздуха. Для анализа необходимо не менее 250 мл воды в чистой стеклянной посуде.
| Оценка воды | Жесткость, мг•экв/л | Жесткость, выраженная в градусах по шкалам | |||
| русской, немецкой | французской | английской | американской | ||
| Очень мягкая | До 1,5 | До 4,2 | До 7,5 | До 5,27 | До 75 |
| Мягкая | 1,5-3 | 4,2-8,4 | 7,5-15,0 | 5,27-10,53 | 75-150,13 |
| Умеренно жесткая | 3-6 | 8,4-16,8 | 15-30 | 10,53-21,0 | 150,13-300,27 |
| Жесткая | 6-9 | 16,8-25,2 | 30-45 | 21,0-31,6 | 300,27-450,4 |
| Очень жесткая | Свыше 9 | Свыше 25,2 | Свыше 45 | Свыше 31,6 | Свыше 450,4 |
Для определения жесткости воды в домашних условиях нужно иметь несложное лабораторное оборудование и реактивы. В качестве лабораторного оборудования (рис. 12) необходимы микробюретка (1 шт.), измерительные градуированные пипетки (2 шт.), стеклянные колбы (2 шт.), химические стаканы на 100 мл (2 шт.), мерный цилиндр (1 шт.).
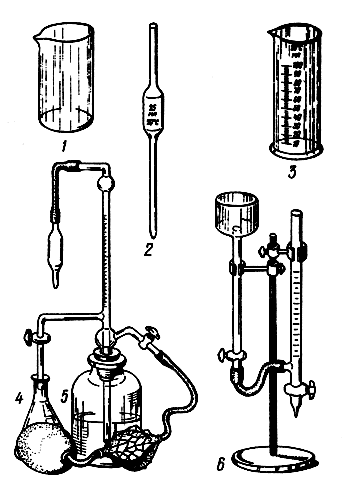
Рис. 12 Лабораторное оборудование: 1 — химический стакан; 2 — измерительная пипетка; 3 — мерный цилиндр; 4 — стеклянная колба; 5,6 — микробюретки
Из реактивов используют буферный раствор, сульфид натрия (Na2S), индикаторную жидкость (хромоген черный ЕТ-00), трилон Б.
Ход анализа. Посуду тщательно моют водопроводной, а затем дистиллированной водой. В две колбы наливают по 100 мл исследуемой воды и в каждую добавляют 5 мл буферного раствора (набирают пипеткой), 1 мл сульфида натрия и 5—6 капель индикаторной жидкости. Содержимое хорошо перемешивают. Полученные растворы окрашиваются в марганцово-розовый цвет. Затем их титруют трилоном Б, добавляя его в каждую колбу маленькими каплями, пока раствор не станет синим. После этого отмечают количество миллилитров трилона Б, израсходованного на титрование в каждой колбе.
Пример. На титрование раствора в первой колбе израсходовано 0,43 мл трилона Б, а во второй колбе 0,41 мл. Среднюю величину израсходованного реактива определяем по формуле Vcp= = (V1 + V2)/2= (0,43+0,41)/2= 0,42 мл. Содержание кальция и магния (общую жесткость) вычисляем по формуле Ж = VcpN/V = 0,42×0,1×1000/100 = 0,42 мг•экв/л, где Vcp — количество трилона Б, пошедшего на титрование, мл; N — нормальность трилона; 1000 — пересчет на 1 л воды; V — объем исследуемой воды.
Для изготовления каркасных аквариумов используется уголок из оцинкованного железа, меди, дюраля и других металлов. В результате длительной эксплуатации аквариумов возможны случаи соприкосновения воды с металлическими частями. В этом случае в воде может появиться большое количество токсических веществ, приносящих вред обитателям аквариума, кроме того, в грунте и воде аквариума всегда присутствуют ионы различных металлов. При ведении большого аквариумного хозяйства может возникнуть необходимость в раздельном определении количества кальция и магния в воде аквариума. Для этих целей в городских, районных клубах аквариумистов или других государственных учреждениях должно быть выделено отдельное помещение, оборудованное необходимыми современными приборами для проведения комплексно-метрического анализа воды на присутствие ионов различных металлов и на раздельное определение количества кальция и магния. Комплексно-метрический анализ воды позволяет определить:
жесткость сырой и осветленной воды при отсутствии ионов меди, цинка и марганца;
жесткость воды типа конденсата и смягченной воды при отсутствии ионов цинка, меди и марганца;
жесткость воды, в которой есть ионы меди и цинка;
раздельное определение кальция и магния.
Принцип метода, необходимые реактивы и их приготовление, а также ход химических анализов для каждого пере числен но го выше случая приводятся ниже.
Набор реактивов: трилон Б — 125 г; хромоген черный ЕТ-00—25 г; кислотный хромтемно-синий — 25 г; сульфат магния (фиксанал) — 5 ампул; мурексид — 10 г.
Принцип метода. Трилон Б (натриевая соль этилендиаминогетрауксусной кислоты) образует растворимые в воде внутрикомплексные соединения с катионами различных двух- и трехвалентных металлов. Они обладают различной прочностью и образуются при определенных для каждого катиона значениях рН. К числу катионов, с которыми трилон Б образует комплексы, относятся катионы кальция, магния, меди, цинка, марганца, кадмия, никеля, двух- и трехвалентного железа, алюминия и др. Если в раствор, содержащий ионы одного из вышеупомянутых металлов, ввести индикатор, дающий непрочное цветное соединение с ионами этого металла, то при добавлении трилона Б к окрашенному раствору в эквивалентной точке произойдет изменение окраски.
В качестве индикатора для определения кальция и магния могут быть взяты хромоген черный ЕТ-00, кислотный хромсиний К и кислотный хромтемно-синий. Для определения железа используются индикаторы роданистый аммоний и сульфосалицилевая кислота. Для определения меди и кальция в качестве индикатора применяют пурпуреат аммония (мурексид). Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Жесткость воды определяется при рН выше 9, железо при рН 1—2, кальций с индикатором мурексидом при рН около 12; медь может быть определена в широком интервале рН — от 3,5 до 12.
Необходимые реактивы и их приготовление. Для проверки качества воды, используемой для приготовления реактивов, необходим высококачественный дистиллятор, не содержащий даже следов меди. Он может быть изготовлен из жароупорного стекла. Рекомендуется пользоваться водой, перегнанной в стеклянном аппарате или Н-катионированной. Качество дистиллированной воды испытывают следующим образом: к 100 мл дистиллята прибавляют 1 мл аммиачного буферного раствора и 5—7 капель индикатора кислотного хромтемно-синего. Голубая с сиреневым оттенком окраска раствора указывает на чистоту воды.
Растворы трилона Б. Для приготовления растворов берут следующие навески: для 0,1 н. — 18,6 г трилона Б; для 0,05 н. — 9,3 г и для 0,01 н. — 1,86 г. Отвешенное количество вещества растворяют в дистиллированной воде и фильтруют (если раствор получится мутным, объем доводят до литра). Для установки титров растворов разной нормальности берут различные объемы 0,01 н. раствора соли магния: для нормальности 0,1—100 мл раствора соли магния; 0,05—50 и 0,01—10 мл.
Объем взятого раствора соли магния доводят дистиллированной водой до 100 мл, добавляют 5 мл аммиачного буферного раствора, 5—7 капель одного из хромовых индикаторов и медленно титруют (при интенсивном перемешивании раствора трилона Б соответствующей нормальности) до отчетливого изменения цвета раствора. При установке титра 0,01 н. раствора трилона Б необходимо пользоваться хромтемно-синим индикатором, как наиболее чувствительным. Поправочный коэффициент раствора трилона Б к данной нормальности вычисляют по формуле KTp=10KMg/a, где а — расход трилона Б на титрование, мл; КMg — поправочный коэффициент 0,01 н. раствора соли магния (коэффициент нормальности 0,01 н. раствора К Mg=1).
Буферный раствор. 20 г хлористого аммония химически чистого растворяют в дистиллированной воде, добавляют 100 мл 25%-ного раствора аммиака и доводят до 1 л дистиллированной водой.
Растворы индикаторов — хромоген черный ЕТ-00, кислотный хромтемно-синий 0,5 г. Один из индикаторов растворяют в 20 мл аммиачного буферного раствора и доводят до 100 мл этиловым спиртом. Раствор хромогена черного ЕТ-00 следует готовить на срок не более 10 суток. Раствор мурексида готовят следующим образом. Мурексид (пурпуреат аммония) в количестве 0,03 г растворяют в 10 мл дистиллированной воды. Полученный раствор хранят в темном месте не более 4 дней. Применяют его для определения меди и кальция.
Раствор сульфата натрия — 2—5%-ный водный раствор. Хранят его в опарафиненной склянке или сосуде из плексигласа, готовят на срок не более 2 недель.
Диэтилтиокарбонат натрия готовят в виде 3%-ного водного раствора из пере кристаллизоваиного продукта, который перекристаллизовывают из спиртового или ацетонового раствора.
Раствор солянокислого гидроксиламина делают так: 1,0 г NH2•ОН•HCl растворяют в дистиллированной воде и объем раствора доводят до 100 мл.
Раствор соли магния 0,01 н. концентрации готовят растворением содержимого ампулы фикса нала в дистиллированной воде, после чего доводят объем до литра (титр не устанавливают). Если фиксатор отсутствует, берут навеску на аналитических весах, равную 1,2325 г сульфата магния (MgSO4•7H2O), помещают ее в мерную колбу емкостью 1 л, растворяют в дистиллированной воде и доводят объем до метки. Титр 0,01 н. раствора соли магния устанавливают или прямым весовым методом, определяя содержание магния, или косвенным, определяя кислотность Н-катионированного раствора соли магния. По полученным данным рассчитывают коэффициент нормальности раствора соли магния.
Определение жесткости сырой и осветленной воды (при отсутствии ионов меди, цинка и марганца). При жесткости воды выше 20 мг- экв/л можно производить титрование пробы 0,1 н. раствором трилона Б. При жесткости от 0,5 до 20 мг•экв/л следует пользоваться 0,05 н. раствором трилона Б, а ниже 0,5 мг•экв/л — применять 0,01 н. раствор. К определенному, точно измеренному объему испытуемой прозрачной воды добавляют дистиллированной воды (до общего объема в 100 мл), 5 мл аммиачного буферного раствора, 5—6 капель индикатора и медленно титруют раствором трилона Б, хорошо перемешивая до изменения цвета раствора.
Кислые воды должны быть предварительно нейтрализованы щелочью в присутствии метилоранжа. Жесткость воды рассчитывают по формуле Ж=1000акн/V мг•экв/л, где V — объем пробы, взятой для титрования, мл; н — нормальность раствора трилона Б; а — число миллилитров раствора трилона Б, израсходованное на титрование данного объема пробы; к — поправочный коэффициент раствора трилона Б к данной его нормальности. Если содержание железа или алюминия в воде превышает 10 мг/л, пробу разбавляют дистиллированной водой (при расчете жесткости учитывают это разведение).
Воду после известкования, в зависимости от требований к анализу, можно отфильтровать от грубодисперсного карбоната кальция, а затем титрованием трилоном Б определить оставшуюся после известкования жесткость воды. Для определения общей жесткости известковой воды надо разложить присутствующий карбонат кипячением ее с соляной кислотой, затем нейтрализовать избыток последней по метилоранжу и титровать как обычно, трилоном Б. Воду, имеющую температуру ниже 10—12° С, перед титрованием следует подогревать.
Определение жесткости воды типа конденсата и умягченной воды. Жесткость смягченных вод определяется с применением кислотного хромтемно-синего. К 100 мл пробы добавляют 5 мл аммиачного буферного раствора, 5—6 капель индикатора и медленно титруют из микробюретки 0,01 н. раствором трилона Б до изменения цвета раствора. Жесткость рассчитывают по формуле Ж=0,1ак мг•экв/л, где к — поправочный коэффициент 0,01 н. раствора трилона Б; а — число миллилитров 0,01 н. раствора трилона Б, израсходованное на титрование 100 мл пробы.
Определение жесткости воды, содержащей ионы меди и цинка. Присутствие меди в воде определяется по точке перелома цветности раствора. Наличие в воде цинка определяют следующим образом. К пробе воды, взятой для определения жесткости, прибавляют 1 мл раствора сернистого натрия, затем в обычной последовательности буферный раствор, индикатор и титруют трилоном Б. Концентрацию раствора трилона Б выбирают в зависимости от величины жесткости анализируемой воды. Расчет сохраняется прежним. Изменение окраски раствора бывает отчетливым.
Определение жесткости воды, содержащей ионы марганца. Присутствие марганца в пробе распознается по следующему признаку: через некоторое время после прибавления к воде буферного раствора и индикатора цвет ее изменяется, переходя в серый, и титрование становится невозможным. Определение в этом случае производят в следующем порядке: до ввода реактивов добавляют три капли раствора солянокислого гидроксиламина, затем буферный раствор, индикатор и титруют раствором трилона Б соответствующей концентрации. Точка перехода отчетлива. Расчет остается прежним, но определяемая жесткость оказывается завышенной на величину содержания марганца.
Раздельное определение кальция и магния. Ионы кальция образуют в щелочной среде с мурексидом соединение оранжево-розового цвета. При отсутствии ионов кальция цвет мурексида при тех же значениях рН (выше 10) лиловый. Определение возможно при содержании кальция не менее 0,03 мг•экв/л. Объем пробы для титрования и нормальность раствора трилона Б сохраняются теми же, какие были указаны в разделе «Определение жесткости сырой и осветленной воды». Устранение влияния мешающих ионов производится тем же способом, как указано выше.
При определении кальция с мурексидом восстановленный марганец не титруется трилоном Б. К определенному объему испытуемой воды, доведенному дистиллятом до 100 мл, добавляют 5 мл 2 н. раствора едкого натрия, 2—5 капель раствора мурексида и медленно титруют раствором трилона Б до изменения окраски раствора. Определение выполняют в двух пробах, причем первую после отсчета расхода трилона Б на титрование слегка перетитровывают и используют в качестве контроля при титровании второй пробы.
Содержание кальция вычисляют по формуле: Са=нка•1000/V = мг•экв/д где н — нормальность трилона Б; к — поправочный коэффициент трилона Б данной нормальности; а — число миллилитров трилона Б, израсходованного на титрование; V — объем пробы, мл.
Содержание магния вычисляют как разность между величиной общей жесткости и величиной содержания кальция.
Смягчение воды для аквариума. Вода по степени жесткости бывает дистиллированная (0,8—2,3°); химически обессоленная (0,2—0,4°); подлежащая обработке (6—15°). Ориентировочные данные для приготовления воды нужной жесткости приведены в табл. 6 (таблица дает необходимые данные в том случае, если мы пользуемся водой с жесткостью 0,4°).
| Требуемая жесткость, H0 | Количество дистиллированной воды, мл, добавляемой к 1 л водопроводной | |||||||||
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 3 | 1000 | 1350 | 1650 | 2000 | 2350 | 2680 | 3000 | 3350 | 3670 | 4000 |
| 4 | 500 | 750 | 1000 | 1250 | 1500 | 1750 | 2000 | 2250 | 2500 | 2750 |
| 5 | 220 | 400 | 650 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 |
| 6 | - | 170 | 320 | 520 | 660 | 820 | 1000 | 1200 | 1400 | 1600 |
| 7 | - | - | 140 | 220 | 440 | 560 | 700 | 840 | 980 | 1120 |
| 8 | - | - | - | 125 | 250 | 380 | 500 | 650 | 810 | 980 |
(Примечание. По горизонтали указана жесткость водонапорной воды, по вертикали - требуемая жесткость)
Пример. Жесткость водопроводной воды 6; необходимо получить воду жесткостью 3. В графе, находящейся под цифрой 6, находим данные, соответствующие цифре 3 вертикального столбца. Из таблицы видно, что для получения нужной жесткости к 1 л водопроводной воды следует добавить 1 л дистиллированной.
Жесткость воды можно уменьшить химическим путем, если применить в аквариуме пермутитовые фильтры, содержащие натрий, который вступает в химическую реакцию с растворенными в воде солями кальция. В процессе фильтрации воды пермутит поглощает соли кальция, выделяет натрий, и вода смягчается. Для повышения жесткости воды грунт для аквариумов необходимо брать с большим количеством известняка и мрамора.
Диссоциация воды. Водородный показатель. Одним из наименее диссоциированных веществ, образующихся при реакциях между ионами, является вода. Чистая вода плохо проводит электрический ток, но все же обладает некоторой измеримой электропроводностью, которая объясняется небольшой диссоциацией воды на водородные и гидроксильные ионы (Н2О=H++OH-). Вычисленная по электропроводности концентрация ионов водорода и гидроксила в воде равна 10-7 г•ион/л при 22°С. Поскольку электролитическая диссоциация обратима, она подчиняется закону действия масс. Поэтому процесс диссоциации воды можно записать как [Н+]•[OH-]/H2O=K. Преобразуя это уравнение, получим [Н+]•[ОН-] = [Н2O] К. Но степень диссоциации воды очень мала и концентрацию недиссоциированных молекул в ней, а также в любом разбавленном водном растворе можно считать величиной постоянной. Из этого следует, что в правой части уравнения находятся две постоянные величины: Н2О — концентрация недиссоциированных молекул воды и К — константа диссоциации. Но произведение двух постоянных величин есть также величина постоянная. Поэтому, заменив Н2О•К новой константой, получим [Н+]•[ОН-] = КН2O. Следовательно, как бы ни изменялись концентрации ионов Н+ и ОН- в воде или в разбавленном водном растворе, произведение их остается величиной примерно постоянной. Эту величину называют ионным произведением воды. Числовое значение этой константы нетрудно найти, подставив в уравнение величины концентрации водородных и гидроксильных ионов в воде: КН2O=[Н+]•[OH-]=10-7•10-7=10-14. Реакцию того или иного раствора принято характеризовать только концентрацией водородных ионов, так как концентрацию ионов ОН- легко вычислить, исходя из ионного произведения воды. Допустим, что к чистой воде прибавили кислоты и концентрация ионов Н+ достигла 10-3 г•ион/л. Тогда концентрация ионов ОН- в растворе будет [OH-] = KН2O/[H+] = 10-14/10-3=10-11. Наоборот, если прибавить к воде щелочи и тем повысить концентрацию гидроксильных ионов, например до 10-5, концентрация водородных ионов станет [H+] = 10-14/10-5=10-9.
Следовательно, как кислотность, так и щелочность раствора можно количественно характеризовать концентрацией водородных ионов. В нейтральных растворах концентрация ионов водорода равна концентрации гидроксильных ионов. В кислых растворах концентрация ионов Н+ больше, а в щелочных меньше. Нейтральный раствор — [Н+]=[ОН-]=10-7г•ион/л; кислый — [Н+]>10-7; щелочной — [Н+] г.ион/л.
На практике среду раствора обычно характеризуют не самой концентрацией водородных ионов, а так называемым водородным показателем.
Водородный показатель, обозначаемый через рН, представляет собой отрицательный логарифм концентрации водородных ионов: рН=—lg[H+]. Например, если концентрация водородных ионов [Н+]=10-5 г•ион/л, то рН=5, если [Н+] = 10-9 г•ион/л, то рН=9, и т.д.
Очевидно, что нейтральные растворы имеют рН= 7, в кислых растворах рН<7, а в щелочных рН>7. В аквариумной практике вода, соответствующая рН 2—3, считается сильно окисленной; 3—5 — кислой; 5—6 — слабокислой; 6—7 — очень слабокислой; 7 — нейтральной; 7—8 — очень слабощелочной; 8—9 — слабощелочной; 9—10 — щелочной; 10—14 — сильно щелочной.
Измерение рН в домашних условиях можно рекомендовать простым способом. Его принцип основан на цветной цифровой шкале; точность измерения до 0,1 ед. Возможно измерение рН с помощью бумажных индикаторов, пропитанных составом из органических красителей; точность измерения — до 0,3 ед.
Для кружков и клубов аквариумистов, имеющих специальные лаборатории, где при измерении рН требуются высокие точности и имеет значение экономия времени на измерениях, можно рекомендовать лабораторный многопредельный измеритель ЛПУ-01 с датчиком ДЛ-01, предназначенным для определения активности ионов водорода в водных растворах. Принцип измерения величины рН с помощью измерителя ЛПУ-01 заключается в следующем.
Для определения величины рН используется электродная система со стеклянным электродом, электродвижущая сила которого зависит от активности ионов водорода в растворе. Схема такой электродной системы показана на рис. 13. Стеклянный электрод представляет собой трубку с напаянным на конус полым шариком из литиевого электродного стекла. При погружении электрода в раствор между поверхностью шарика и раствором происходит обмен ионами, в результате которого ионы лития в поверхностных слоях стекла замещаются ионами водорода, и стеклянный электрод приобретает свойства водородного электрода. Между поверхностью стекла и контролируемым раствором возникает разность потенциалов Ех, величина которой определяется активностью ионов водорода в растворе по формуле
Ex=RT/F. ln(aн)=2,3(RT/F)pH
где R — универсальная газовая постоянная, равная 8,315×107эрг/°С моль; Т — температура раствора, К; F — 96500 кулон/г•экв (число Фарадея); ан — активность ионов водорода в растворе.
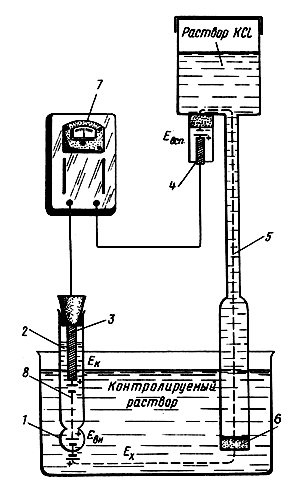
Рис. 13 Схема электродной системы рН-метра ЛПУ-01: 1 — полый шарик из электродного стекла; 2 — раствор, заполняющий внутреннюю полость электрода; 3 — внутренний контактный электрод; 4 — вспомогательный электрод; 5 — электролитический контакт; 6 — пористая перегородка; 7 — рН-метр ЛПУ-01; 8 — стеклянный электрод
Подготовку к работе измерителя ЛПУ-01 и определение активной реакции воды производят согласно прилагаемой к прибору инструкции по эксплуатации.
После тщательной промывки аквариума и грунта обычной водопроводной водой воду в аквариуме подкисляют. Для этого в нее добавляют вываренный торф, ивовый корень, ольховые шишки и другие кислые вещества. Применение химических кислот не рекомендуется. В аквариуме, простоявшем более года без полной смены воды и промывки грунта, вода имеет слабокислую или очень слабокислую реакцию. Большинство же растений успешно произрастают лишь при нейтральной рН или близкой к ней.
Кислород. Важным условием жизни водных растений является кислород. Недостаток в воде кислорода может привести к болезням или гибели растений. Недостаток кислорода в аквариуме наблюдается при плохом освещении аквариума в зимнее время или летом в плохую погоду. Чтобы устранить это неблагоприятное явление, необходимо равномерно обогащать воду воздухом с помощью компрессора или создать циркуляцию воды в аквариуме с помощью помпы. В некоторых случаях необходимо частично очистить и удалить гниющие вещества, которые расходуют кислород. Даже процесс смены воды в аквариуме обогащает ее кислородом. При содержании в аквариуме рыб и растений из проточных водоемов, расположенных в средней географической полосе, сильный продув воды воздухом особенно необходим.
Углекислый газ. Углекислота в воде образуется за счет дыхания рыб и растений, разложения органических веществ, которое увеличивается с повышением температуры воды. Кроме того, в воде растворяется углекислый газ воздуха. Углерод, содержащийся в углекислоте, прекрасно усваивается растениями и идет на построение их тканей. Количество углекислого газа в воде непостоянно и зависит от времени суток: днем уменьшается, в ночное время увеличивается. В зимние месяцы среднесуточное содержание углекислого газа в воде больше, чем в летние. Его количество зависит от размера аквариумных рыб, видов и количества растений, а также от правильного ухода за аквариумом.
В аквариуме, где годами не промывался грунт, может образоваться большое количество сероводорода, который очень ядовит. Присутствие сероводорода определяют по резкому неприятному запаху. В таких случаях требуется чистка аквариума.
Значение химических свойств воды для аквариума. В аквариуме постоянно происходит обмен газов. Присутствие кислорода и углерода в необходимых количествах является важным условием для жизни рыб, растений и микроорганизмов. Но количество этих важных элементов необходимо регулировать.
Очень важно знать, что при изменении содержания в воде кислорода и углекислого газа изменяется ее активная реакция. При увеличении содержания кислорода и уменьшении углекислого газа происходит увеличение рН и наоборот. Величина рН влияет на все биологические и биохимические процессы, протекающие в аквариуме. Следует отметить, что свежая дистиллированная вода содержит в 10 раз больше углекислого газа. Показатель рН такой воды может быть 5,5 и ниже. На воздухе этот избыток углекислого газа удаляется из воды очень медленно. Равновесия с углекислым газом воздуха можно достичь, если оставить такую дистиллированную воду на 1,5—2 недели в открытом сосуде (но защищенном от пыли). За это время рН ее резко повысится. Вот почему нельзя помещать рыб и растения в только что приготовленную дистиллированную воду.
Резкое изменение рН воды живые организмы переносят очень болезненно: нарушается обмен веществ, что часто приводит их к гибели. Необходимо помнить, что в пресных стоячих водах и в обычной аквариумной воде существует определенная зависимость между кислотностью и жесткостью воды. Если вода мягкая, она слабокислая, что объясняется отсутствием углекислых солей кальция и магния и присутствием гуминовых кислот. Если же вода жесткая, она, как правило, щелочная. При приготовлении воды для аквариума аквариумист, используя различные способы, может создать искусственно жесткую воду с низким рН.
Физические свойства воды
Температура. Температурный режим воды в аквариуме зависит от географического места расположения водоема, в котором произрастали взятые для аквариума растения. Солнечный свет, проникая в воду, повышает ее температуру, поэтому чем больше света, тем теплее вода. Способность проводить тепло у воды невелика, но все же слои воды в природных водоемах перемешиваются и температура воды выравнивается. В глубоких водоемах между верхними и нижними слоями существует значительная разница в температуре, но она относительно постоянна, не имеет резких скачков и меняется плавно. К таким плавным изменениям температуры приспособлены животные и растительные организмы.
Перепад температуры воды в аквариуме — явление нежелательное, а резкие температурные колебания вообще недопустимы, поэтому воду нужно все время перемешивать при помощи аэрации или искусственного потока. Небольшое изменение температуры воды, на 2—4°С, в зависимости от времени суток, допустимо для растений.
Вода в аквариуме не должна подвергаться большим температурным колебаниям. Обычно температурные колебания наблюдаются, если аквариум установлен в непосредственной близости от окна или на подоконнике. Особенно опасно, если окно обращено в сторону юга. Значительные отклонения от оптимальных температурных условий и резкое изменение температуры выше допустимых пределов приводят к ослаблению жизненных функций растений. Исключением могут быть растения, живущие в водах с резкими колебаниями температуры, так как в этом случае растения приспособлены к ним.
Для развития наземных растений наиболее благоприятной температурой является высшая для определенного географического района, а для водных растений это не всегда справедливо. Указанное явление можно объяснить тем, что с повышением температуры растворимость газов в воде значительно уменьшается, следовательно, кислорода и углекислоты некоторым растениям не хватает, что отрицательно сказывается на их развитии. Этим можно объяснить развитие многих водорослей весной и исчезновение их летом, а также вторичное появление их осенью. Постоянство температуры в аквариуме обеспечивается с помощью терморегулятора.
Прозрачность, цветность и запах воды. Вода из водопровода, предназначенная для заливки в аквариум, прозрачна и бесцветна. После заливки воды и соприкосновения ее с грунтом, растениями и животными в ней начинают развиваться бактерии и происходить сложные процессы. Она становится нежно-голубой, затем беловато-мутной, а через несколько дней, иногда и недель после установившегося выровненного режима — прозрачной с голубоватым оттенком. После этого аквариум подготовлен к заселению рыбами и растениями.
Растения, рыбы и другие обитатели аквариума меняют химические и физические свойства воды. Природу этого изменения точно еще не знают, но легко убедиться в том, что такая вода благоприятно действует на рыб, предотвращает их заболевания, способствует нормальному развитию растений. Такую воду аквариумисты называют старой. Она прозрачная, с желтоватым оттенком. Биологические преимущества «старой воды» полностью сохраняются при смене 1/5 ее объема раз в неделю.
В аквариуме, залитом свежей водой, появляется бактериальная муть, которая со временем исчезает. Помутнение воды может быть вызвано применением глинистого песка, развитием микроскопических водорослей, результатом роющей деятельности некоторых видов рыб. Цветность воды зависит в основном от ее составных частей. Она может быть зеленой, голубой, голубовато-зеленой, белесой, коричневой и других цветов.
В хорошо устроенном и засаженном растениями аквариуме вода приобретает специфический запах. Если отлить 1/5 объема воды из такого аквариума и добавить часть свежей, то спустя несколько часов, наклонившись над ее поверхностью, можно почувствовать запах свежей травы. Ничем другим вода в аквариуме пахнуть не должна. Это наилучший способ проверки качества воды в аквариуме. Если вода имеет затхлый аммиачный запах, это указывает на неблагоприятные условия в аквариуме. В этих случаях требуется полная смена воды и промывка грунта. Можно проверить прозрачность воды визуально. По степени прозрачности вода может быть охарактеризована как «прозрачная», «незначительная муть», «при отстаивании муть оседает» или «не оседает». Для характеристики прозрачности применяют плоскодонный цилиндр с градуировкой, расположенный на подставке высотой 40 см. Снизу подкладывают стандартный текст и в цилиндр наливают воду до тех пор, пока можно читать текст. Затем подливают воду и снова снижают ее уровень, пока текст опять не станет разборчивым. Выраженная в сантиметрах высота столба воды, при котором можно читать текст, и характеризует прозрачность.
Давление воды. Вода давит не только на стенки аквариума, но и на любое тело, в том числе на живой организм, находящийся в ее толще. Рыбы и другие водные животные и растения прекрасно приспособлены к этому давлению. Ткани растений наполнены водой, вода снаружи давит на воду внутри тканей и давление уравновешивается. Чем глубже от поверхности воды находится живой организм, тем большее давление он испытывает, а следовательно, тем большее внутреннее «противодавление» он должен иметь, иначе вода его раздавит. Соответственно своим жизненным потребностям водные организмы выбирают для обитания именно тот слой воды, который им нужен.
В аквариумной практике приходится пользоваться водопроводной или колодезной водой, которая по своим свойствам очень разнообразна. Соприкасаясь с грунтом, растениями, рыбой, с продуктами гниения и щелочноземельными элементами, вода приобретает новые свойства. В аквариуме вода должна быть свободна от примесей любых металлов, не должна содержать большого количества солей магния, кальция и никаких других составных частей, вредных для обитателей аквариума.
В сельской местности часто приходится пользоваться колодезной, речной и озерной водой. До заливки воды в аквариум ее необходимо нагреть до температуры 70°С, тем самым частично освободить ее от нежелательных микроорганизмов. Водопроводную воду необходимо отстаивать в неметаллической посуде в течение нескольких дней, так как в ней имеются дезинфицирующие вещества. Применение воды из пруда не рекомендуется. Дождевая и снеговая вода (вблизи города) также непригодна, так как содержит большое количество вредных веществ в твердом, жидком и газообразном состоянии. В сельской местности применение такой воды возможно, но она должна быть отфильтрована от пыли и других веществ.
При подготовке аквариума для заливки водой в него должен быть внесен грунт, подготовлены растения для посадки. Желательно часть грунта и воды взять из другого аквариума, если такая возможность имеется. Тем самым будут внесены нужные микроорганизмы и ускорен процесс восстановления режима аквариума.
После указанной подготовки можно приступить к заливке аквариума водой. Воду наливают сначала на перевернутую тарелку до уровня 10—15 см, после чего сажают растения. После этого аквариум заполняют водой до уровня 3—5 см от его верхней кромки. В первые дни после заливки в аквариуме бурно идут химические и биологические процессы (об этом свидетельствует помутнение воды). Полностью меняют воду в аквариуме в исключительных случаях: при занесении патогенных микроорганизмов, появлении грибковой слизи, бурном «цветении» воды, не прекращающемся при временном затемнении аквариума, и при загрязненности грунта. От полной смены воды растения страдают: происходит обесцвечивание и преждевременное отмирание листьев. Если аквариум правильно заселен, растения, рыбы и бактерии могут заменить хороший фильтр.
Для очистки воды от помутнения хорошо применять дафний, маленьких головастиков или небольшое количество поваренной соли.
|
ПОИСК:
|
© Злыгостев Алексей Сергеевич, 2001-2019
При использовании материалов сайта активная ссылка обязательна:
http://aquariumlib.ru/ 'Библиотека по аквариумистике'
При использовании материалов сайта активная ссылка обязательна:
http://aquariumlib.ru/ 'Библиотека по аквариумистике'