
ХАРАКТЕРИСТИКА ВОДЫ АКВАРИУМА
По отношению к среде обитания всех рыб можно разделить на 4 группы: морские, пресноводные, тропические, холодноводные (табл. 2).
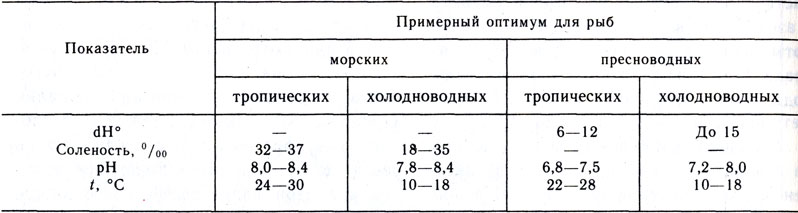
Таблица 2. Условия содержания морских и пресноводных рыб
Помимо указанных, еще выделяют солоноватоводных рыб (Abudefduf assimilis, Dules taeniura, Tricanthus brevirostris и т. п.), которые имеют расширенный диапазон жизненных условий. До года они хорошо чувствуют себя в пресной воде или солоноватой (до 5 ‰). Затем соленость повышают вплоть до океанической (35 ‰), и только при разведении может возникнуть необходимость в обратном ее опреснении. Для успешной работы аквариумистам необходимо уметь определять и регулировать основные качества и свойства воды.
Основное преимущество природных экосистем — их сбалансированность и цикличность. В состав морской воды входит вся периодическая система Менделеева, тогда как в пресной воде зарегистрировано около 70 элементов, из которых наиболее важны марганец, алюминий, цинк, медь, хром, титан, молибден, иод, свинец, барий, бром, стронций и др. В природных водах, хотя и в очень незначительных количествах, всегда содержатся витамины A, B1, B6, H и С, ферментные соединения, каротиноидное вещество, обладающее флуоресцентными свойствами.
Физические свойства воды. Живая вода благополучного аквариума чуть отдает ароматом свежескошенной травы или морских водорослей. Она так прозрачна, что даже сквозь 3-метровую толщу можно без труда наблюдать за рыбами. Индикатором высокого качества воды служит присутствие в ней ветвистых (Friedericella sultana) и стекловидных (Crystatella mucedo) колоний мшанок, а также карликовых гидромедуз (Craspedocusta, Limnocnida). В морской воде за показатель здоровья системы принимают хорошее самочувствие беспозвоночных, в частности, кораллов.
Максимальная прозрачность в Саргассовом море достигает 66 м, а в пресных озерах (Байкал, Танганьика) не превышает 40 м. Цветность воды — результат взаимодействия падающего света с содержащимися в ней примесями. Так, воды с низкой биологической продуктивностью синие и очень прозрачные; высокие концентрации неорганических биогенных веществ, повышение температуры и увеличение освещенности вызывают зеленую окраску, или цветение, воды. Красные морские приливы обусловлены массовым размножением динофлагелятт (Gonyaulax, Peridinium и др.), пурпурных бактерий (Rhodopseudomonas, Thiocystis и др.), равноресничных инфузорий — циклотрихиум (Cyclotrichium meunieri) и других растительных и животных организмов. Большое количество дубильных веществ (например, танина) и гуминовых кислот обусловливает черно-бурые тона. Белесая муть в свежеоборудованном аквариуме — результат резкой бактериальной вспышки, спадающей лишь после 3—10-дневного отстоя (ускорить процесс можно озонированием или добавлением в воду метиленовой сини — 1 мг/л).
Температура воды одинаково влияет на протекание физиологических процессов и физико-химических реакций. При ее повышении на 10 °С в 2—3 раза ускоряется обмен веществ в живом организме, уменьшается плотность морской воды и растворимость газов, многократно возрастает активный перенос элементов и их взаимодействие. Эвритермные рыбы хорошо чувствуют себя в широком диапазоне температур, стенотермные предпочитают узкий термоинтервал. Температура, превышающая оптимум, подавляет рост рыб и влияние фотопериода.
При высокой температуре развитие икры идет быстрее, но молодь получается слабой и мелкой. При низкой температуре личинка выходит значительно крупнее, однако процесс вылупления растягивается, к тому же появляются мутанты с искривленным позвоночником, укороченным туловищем, мопсовидным «лицом», а подчас и сиамские близнецы, сросшиеся различными участками тела.
Без активной аэрации и фильтрации циркуляция воды в прямоугольных аквариумах обычно характеризуется наличием мертвых зон и отдельных мелких завихрений, что приводит к стрессам и дискомфорту, особенно у реофильных гидробионтов, живущих на течении.
Химические свойства воды.Активная реакция воды (рН) — важнейшая характеристика. Если в ходе реакции одним из продуктов диссоциации оказывается водород, вода приобретает кислотные свойства, если гидроксильная группа (ОН+) — основные. Нейтральная вода имеет рН 7,0. Эвригидрионные организмы выносят значительные колебания рН, стеногидрионные живут при достаточно стабильной реакции воды. Процессы денитрификации, фотосинтеза и восстановления сульфатов повышают рН, тогда как преобладающие процессы биологического окисления понижают. Экологическое действие рН сказывается через изменение проницаемости наружных клеточных мембран и водно-солевого обмена у гидробионтов. В пресноводном аквариуме рН варьирует от 4,5 до 9,0, в морском — от 7,6 до 8,4.
Измерение рН проводят двумя методами: колориметрическим (например, с помощью бумажных индикаторов) и потенциометрическим (с использованием электронных рН-метров). Для подкисления воды применяют дигидрофосфаты калия или натрия (25—50 г на 100 л) в совокупности с буферным торфяным фильтром. Подщелачивают воду питьевой содой (5—15 г на 100 л). Подгонку рН к нужному значению производят равномерно (0,3 в сут).
Окислительно-восстановительный потенциал воды. Всю совокупность окислительно-восстановительных процессов, происходящих в воде, описывает так называемый редокс-потенциал (Eh). Для его измерения применяют рН-метры с платиновым электродом и специальным электродом сравнения. Количественный расчет ведут в условных единицах редокс-потенциала (rН) по формуле
| rH | Eh | +2pH, |
| 9,92 • 10-5• T |
где Т — абсолютная температура (273+ t) воды в аквариуме. Благоприятный диапазон rН = 27—32. В качестве заменяющей характеристики нередко используют электропроводимость воды, в этом случае оптимальное значение — 300—350 μS (микросименс на 1 см).
Щелочность воды обусловлена присутствием в ней карбонатов, бикарбонатов и гидроксидов. Пресноводный оптимум — 1,8—2,0 ммоль/л. Из ионов щелочных металлов в природных водах чаще всего встречается натрий, реже — калий. Щелочность определяют титрованием 100 мл воды 0,1 М раствором соляной кислоты до полной нейтрализации в ней карбонатов и бикарбонатов. В качестве индикатора используют метиловый оранжевый.
Далее расчет ведут по формуле
РК Х 1,04,
где Р — количество соляной кислоты, пошедшей на титрование; К — поправочный коэффициент НСl.
Окисляемость воды показывает, сколько кислорода нужно для связывания растворенных в ней органических веществ. Пресноводный оптимум — 6—12 мг/л.
Соленость воды выражают в граммах на литр (промилле — %0). На долю хлоридов приходится около 55%0 (исключая Аральское море) общего количества растворенных солей. С изменением солености меняются осмотическое давление, плотность воды. Стимулирующее действие на рост, развитие и созревание пресноводных рыб оказывает соленость 1—3 ‰. Границей между солоноватой и морской водой считают соленость 24,695 ‰. Нормальная плотность морской воды (при солености 34 ‰ и t 20°С) составляет 1,024. Измерения проводят ареометром. Эвригалинные рыбы живут при переменной солености, стеногалинные — при постоянной.
Жесткость воды главным образом зависит от присутствия в ней растворенных солей кальция и магния и подразделяется на временную, или карбонатную, от которой легко избавиться кипячением, и постоянную, или некарбонатную. При высоких значениях рН (более 8,3) осадок карбонатов может частично перейти обратно в раствор. В высокоминерализованных озерах карбонаты кальция и магния могут выпадать в осадок в виде мергеля. Косвенно о степени жесткости воды судят по ее мылкости: мягкая вода при сбивании образует обильную пену, очень жесткая практически не пенится. Справку о жесткости питьевой воды можно получить на водопроводной станции или в районной инспекции санитарно-ветеринарного надзора. К физическим методам уменьшения жесткости относят дистилляцию и электролиз, к химическим — ионообмен (посредством сильных и слабых катионитов и анионитов), обработку известью, щавелевой и фосфорной кислотами, а также диффузионный метод. Простейшие способы смягчения воды — кипячение (15—20 мин) и вымораживание (минерализация льда практически равна нулю). Добавление же 1 мл аптечного (10%) раствора хлорида кальция увеличивает жесткость 1 л воды примерно на 3°, а добавление 1 мл 25%-ного раствора магнезии (сульфата магния) — на 4°.
В СССР за жесткость воды принимается эквивалентная концентрация катионов кальция и магния, выраженная в миллимоль на литр (эквивалентная масса 1 ммоль равна 20,04 мг кальция или 12,16 мг магния). Однако аквариумисты чаще пользуются немецкими градусами жесткости — dGH (Deutsche Gesamt Harte), где общая жесткость обозначается GH (Gesamt Harte), а временная КН (Karbonat Harte). Один градус жесткости соответствует концентрации 10 мг СаО в 1 л воды. Для приведения к единому знаменателю укажем, что 1 ммоль/л равен 2,8 немецким градусам, 3,5 английским или 5 французским. Вода с жесткостью от 0 до 4° считается очень мягкой (бидистиллят и химически обессоленная - 0—0,4°), от 5 до 10° — мягкой, от 11 до 18° — средней жесткости, от 19 до 30° — жесткой и свыше 30° — очень жесткой. Поверхностные воды обычно мягче, чем воды источников, в остальном решающее значение имеет геологическая формация местности (песок, гранит обеспечивают низкую, а известняк, гипсы высокую минерализацию воды). В большинстве случаев преобладает кальциевая жесткость (до 75% общей), хотя в озере Танганьика она, напротив, обусловлена соединениями магния (до 60%). Определение общей жесткости ведут методом комплексонометрического титрования, или, упрощенно, с помощью наборов Алямовского, Тетра тест (ФРГ) и т. п. Наиболее благоприятно соотношение карбонатной и общей жесткости 1:2. Взаимосвязь между рН, карбонатной жесткостью и концентрацией углекислого газа в воде представлена в таблице 3.
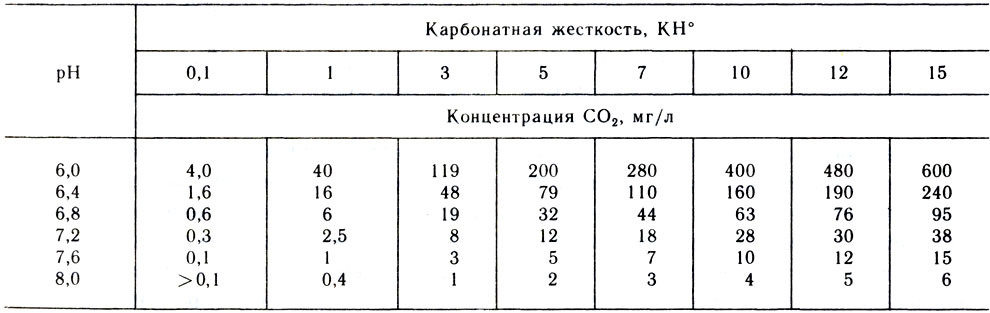
Таблица 3. Связь между активной реакцией воды, карбонатной жесткостью и концентрацией углекислого газа
Газовая характеристика воды. Способность воды растворять газообразные и твердые вещества — важнейшее условие жизни для гидробионтов. При кипячении и в водопроводных трубах вода лишается заключенных в ней газов, но приобретает их снова, постояв некоторое время на воздухе.
Кислород в 28 раз менее растворим в воде, чем углекислый газ, хотя вдвое превосходит по этому показателю азот. Недостаток или избыток кислорода одинаково губителен для рыб и беспозвоночных. При пересыщении воды кислородом у мальков вначале учащается дыхание, затем следуют отрыгивание пищи, выпрыгивание из воды, замедление дыхания, кислородный наркоз, судороги, остановка дыхания и смерть. Растения, поглощающие кислород на свету, ночью также становятся его активными потребителями. При концентрации кислорода в воде свыше 5 мг/л гидробионты могут существовать неограниченное время, если все прочие параметры среды благоприятны. Измерения проводят методом Винклера или электронным оксиметром.
Азот необходим для осуществления таких жизненно важных процессов, как фотосинтез, дыхание, синтез белка, рост организма и пр. Растворимость его в воде обратно пропорциональна температуре и солености и прямо пропорциональна давлению. Иными словами, с увеличением солености и температуры концентрация свободного азота в воде уменьшается, в то время как с повышением давления содержание азота и плотность воды (максимальная плотность при 4 °С) возрастают. С ростом рН равновесие между аммонием (аммонийный азот обычно отсутствует в прибрежных водах весной) и аммиаком сдвигается в сторону последнего. В связи с этим при рН 8,0 аммиак — остротоксичное соединение (предельно допустимая концентрация — 0,025 мг/л), вызывающее массовую гибель гидробионтов. Количество аммонийного азота в морской воде варьирует в пределах 0,006—0,140, нитритов — 0,005—0,161, нитратов — 0,006—0,7 мг/л (предельно допустимая концентрация — 40 мг/л). Нитратов в воде всегда больше. Кроме бактерий, способностью превращать нитраты в нитриты обладают хлорелла, диатомовые водоросли и т. д. Определение нитратов и нитритов проще всего проводить колориметрически.
В чистых озерах содержание углерода колеблется от 1 до 2 мг/л, в сильно загрязненных водах может достигать 25 мг/л и более. Тогда как в 1 л морской воды, как правило, содержится 2 мг углерода и 0,2 мг органического азота. Для присутствия свободного углекислого газа более благоприятны низкие значения рН. В диапазоне рН от 6 до 9 преобладают бикарбонаты. Концентрация СO2 снижается с повышением солености и температуры воды. Углекислый газ, легко поглощаемый кровью, при высоких концентрациях может привести к гибели рыб и беспозвоночных независимо от содержания в воде кислорода.
Фосфор необходим гидробионтам для осуществления внутриклеточных функций (передача энергии ферментным системам и т. д.). Однако чрезмерно высокие его концентрации оказывают ингибирующее действие на рост планктона. Способностью избыточного поглощения фосфатов обладают лишь хлорелла и сценедесмус. Ортофосфорная кислота — основная субстанция для сложных органических соединений (фосфопротеиды, нуклеиновые кислоты, фосфолипиды), представленных в пресноводных и морских организмах. В океанической воде количество фосфатов равно 0,01 — 1,124 мг/л.
Железо содержится, прежде всего, в цитохромной системе растений и животных, участвуя в процессах тканевого обмена и дыхания. Концентрация его составляет 1—5 мкг/л, причем недостатком железа зачастую объясняют плохой рост водных растений в бескаркасных аквариумах. Нержавеющая сталь в морской воде все равно корродирует, к тому же при этом в воду диффундирует хром, что особенно опасно для ракообразных; при мощной аэрации содержание железа и марганца в воде заметно снижается.
Марганец присутствует в морской воде главным образом в виде двухзарядного иона. Иногда встречаются и комплексные соединения с органическим веществом. Для бурного роста фитопланктона марганец необходим в концентрации 0,001 — 0,1 мг/л.
Кремний в количестве 0,5—0,8 мг/л нужен для развития диатомовых водорослей (Asterionella, Tabellaria и др.). Недостаток кремния, азота и фосфора в морских системах, как правило, лимитирует фотосинтез. Концетрация кремния возрастает с увеличением глубины.
Хлор — токсичное и коррозионно-активное вещество. Его избыток (как, впрочем, и других галогенов — иода, брома) удаляют из воды с помощью активированного угля, аэрации, тиосульфата (гипосульфита до 1 г/л) натрия и солей железа.
Продуцированию метана способствуют анаэробные (бескислородные) зоны и низкая (до 5°С) температура. Отлично выводят метан из воды кубышки и нимфеи. А по поведению дафний можно даже определить в воде микродозы наркотиков.
Помимо гидрохимических показателей, на жителей аквариума воздействуют электрические и магнитные поля, ионизирующая радиация, атмосферное давление, гравитация, свет, величина жизненного пространства и другие абиотические факторы. По разработанной Фраем классификации абиотических факторов, влияющих на рыб, температура обусловливает скорости обменных реакций (контролирующий фактор) и осложняет процессы внутренней регуляции (маскирующий фактор); суточные циклы освещенности влияют на функционирование эндокринной системы (направляющий фактор), а каждый из таких показателей, как содержание растворенного в воде кислорода, рацион питания, масса тела и другие факторы, может тем или иным образом сдерживать рост (лимитирующий фактор). Рост особей низкого иерархического ранга подавляется в результате запугивания и террора со стороны соплеменников или посредством водорастворимых ингибирующих веществ.
|
ПОИСК:
|
© Злыгостев Алексей Сергеевич, 2001-2019
При использовании материалов сайта активная ссылка обязательна:
http://aquariumlib.ru/ 'Библиотека по аквариумистике'
При использовании материалов сайта активная ссылка обязательна:
http://aquariumlib.ru/ 'Библиотека по аквариумистике'