
Диссоциация воды. Активная реакция водородных ионов, водородный показатель (рН)
Вода является слабым элетролитом, плохо проводит электрический ток, но обладает некоторой электропроводностью, которая объясняется незначительной диссоциацией воды на катионы водорода Н+ и гидроксилионы ОН- (Н2О ↔ Н+ + ОН-). Концентрация ионов Н+ и ОН- в воде составляет при 22° С - 10-7 г·ион/л. В нейтральной воде концентрация Н+ равна концентрации ОН- ([Н+] = [ОН-] = 10-7 г·ион/л).
Если в ходе реакции уравнение сдвинулось в сторону образования водородных ионов, вода приобретает кислотные свойства, если увеличилось содержание гидроксильных ионов ОН- - свойства воды становятся основными.
Щелочностью воды называют суммарное содержание отрицательно заряженных ионов, которые нейтрализуют ионы водорода при добавлении в воду кислоты. Так, щелочность морской воды, обусловленная буферами (например, буфером борной кислоты, карбонатами и бикарбонатами), составляет 2,1 - 2,5 мг·экв/л. Щелочность пресной воды меньше, но нестабильна. На практике среду раствора характеризуют не концентрацией водородионов, а водородным показателем рН.
рН = - lgH+, то есть, если, например, концентрация водородионов Н+ = 10-5 г·ион/л, то рН = 5; если Н+ ≠ 10-7, рН = 7; если Н+ - 10-12, рН = 12 и т. д.
Кислые растворы имеют рН < 7, нейтральные рН = 7, а щелочные рН > 7. У аквариумистов, в зависимости от концентрации Н+, вода подразделяется на сильно кислую (рН 2 - 3), кислую (рН 3 - 5), слабокислую (рН 5 - 6), очень слабокислую рН 6 - 7), нейтральную (рН=7), очень слабощелочную (рН 7 - 8), слабощелочную (рН 8 - 9), щелочную (рН 9 - 10) и сильно щелочную (рН до 14). Кислая вода уменьшает воздухообмен организма со средой, учащает дыхание организма, изменяя проницаемость наружных клеточных мембран и водно-солевой обмен.
Рыбы по своему отношению к стабильности показателя рН подразделяются на эвригидронных, выносящих значительные колебания рН (до 5 единиц), и стеногидронных (морские организмы, гидробионты Больших Африканских Озер и др.), не приспособленных к резким и значительным колебаниям водородного показателя.
В природе кислая вода образуется в торфяных болотах, старых озерах, а при массовом цветении водоема (размножении сине-зеленых водорослей летом) рН может повышаться до 8 - 10, так как этому способствуют процессы фотосинтеза и денитрифицирующие бактерии.
В старом аквариуме без смены воды рН смещается в сторону окисления, так как этому способствуют процессы накопления и биологического окисления органики. Стабильность рН может обеспечить присутствие карбонатных и бикарбонатных ионов, снижающих содержание в воде углекислоты. Водопроводная и речная вода обычно имеют рН 6,5 - 8,5. В дистилляте после долгого (более 3 недель) выдерживания в темноте рН опускается до 5,5 - 5,3. В аквариумах и водоемах к утру рН, как правило, снижается (дыхание организмов и накопление СO2), а к вечеру (из-за потребления растениями СO2) значение рН повышается. Большинство пресноводных гидробионтов обитает при рН 6 - 9, а морских и солоноватоводных при рН диапазона 7,5 - 8,5. Прокипяченная водопроводная вода, как правило, имеет нейтральную реакцию рН. Для ее подкисления можно использовать отстоенную дистиллированную, обессоленную воду, танин и кислоты - лимонную (осаждающую ионы тяжелых металлов в хелатные комплексы), соляную, ортофосфорную, азотную. Так, для уменьшения значения рН с 8,0 до 5,5 нужно на 1 л водопроводной воды добавить 1 каплю ортофосфорной или 2 капли соляной кислоты. Торф также снижает значение рН либо при длительном (6- 8 месяцев) настаивании, либо при кипячении воды с пластами вымытого верхового торфа. При кипячении 5 - 10 г торфа с 1 л дистиллированной воды до 35 - 40 мин и фильтрацией отвара получается жидкость янтарного цвета с рН, близким к 5,0. Можно рекомендовать подкислить воду в новом аквариуме, заливая ее через гравийно-торфяной фильтр, сделанный из бутылки с обрезанным дном (ток воды до 1 л в минуту) (рис. 5).
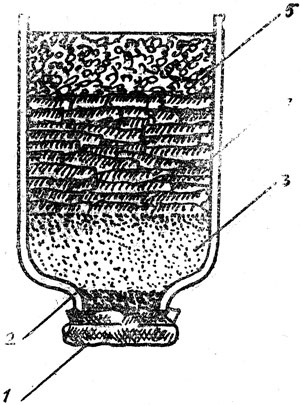
Рис. 5. Устройство гравийно-торфяного фильтра: 1 - капроновая ткань (№ 29); 2 - активированный уголь (3 см); 3 - речной промытый песок (5 см); 4 - торфяные пластины (15 см); 5 - крупный гравий (8- 10 см)
Зоообъединение поставляет в продажу закупленные в ФРГ препараты на основе торфа и вытяжек из него: Tetra Toru Min(для приготовления нерестовой воды - добавка 5 мл на 10 л дистиллята) с гумусовыми и гормональными активными веществами и Tetra Alga Min (для создания в аквариуме воды, близкой по составу к природной торфяной - доза та же, что и для предыдущего экстракта), который содержит гуминовые кислоты и вытяжку из водных растений. Все торфяные отвары, экстракты, настои хранятся в темных герметичных емкостях, в холодильнике при температуре 3 5° С.
Кроме того, можно приготовить отвар дубовой коры и ольховых шишек (на. 1 л дистиллята - 20 г ольховых спелых, промытых горячей водой соплодий и 30 г дубовой коры (из аптеки), варить 45 - 60 мин на медленном огне). Использовать его для подкисления воды в нерестовиках и хранить следует, как торфяной экстракт. Сами ольховые шишки после вываривания можно бросить в аквариум (если воду в нем необходимо постепенно подкислять). Вода со временем приобретет желтоватый оттенок.
В том случае, если увеличить щелочность необходимо быстро, советуем добавить в нее питьевую соду. Делается это следующим образом: сначала соду добавляют в стакан с водой из аквариума, определяют рН и затем, пересчитав количество соды на общий объем, рН доводят до нужных параметров (обычно 5 - 10 г соды на 100 л воды). Концентрация водородных ионов определяется электрометрическим, колориметрическим методами или (приблизительно) с помощью индикаторных лакмусовых бумажек. Универсальные индикаторные бумажки со сравнительной цветовой шкалой выпускаются в СССР. Точность определения рН до 0,5 в интервалах рН от 1 до 10 и от 7 до 14. В ЧССР производится более точный индикатор бумажный "Multiphan" со шкалами от 1 до 13,1 с точностью 0,3.
Способ употребления индикаторных бумажек: погружается на 1 - 2 секунды в исследуемый раствор, пока сама бумажка или метка-полоска на ней не приобретет постоянный цвет. После этого цвет полоски, или метки сравнивается с цветом или меткой на шкале. Чтобы исключить капиллярные изменения окраски в раствор необходимо погружать всю полоску. Сравнивать цвета лучше всего на листе белой бумаги или против света. Срок годности бумажек до 6 лет.
Для более точного колориметрического способа используют приборы Алямовского, Tetra Test рН, В пробирку наливают 5 мл исследуемой воды, прибавляют 0,1 мл универсального приготовленного индикатора и после взбалтывания подбирают в стандартной шкале пробирку, окраска жидкости в которой соответствует цвету исследуемой воды в пробирке с индикатором. Воду для анализа обесцвечивают, фильтруя через слой ваты и активированного угля. Приобретать приборы и реактивы для колориметрирования рекомендуется в магазине,
Электрометрический (потенциометрический) метод основан на измерении рН приборами - рН-метрами (рН-340, рН-47, ЛПУ-01 и др.). Для определения величины рН используется электродная система со стеклянным электродом - его электродвижущая сила зависит от активности ионов водорода в растворе. Между поверхностью стекла и исследуемым раствором возникает разность потенциалов Eх, величина которой определяется активностью ионов водорода в растворе по формуле:
| Ex= | RT | lп; |
| F |
| aн=2,3 | RT | pH |
| F |
где R - универсальная газовая постоянная, равная 8,315 × 107 эрг/°C·моль;
T - температура раствора в К;
F - число Фарадея, равное 96500 кулон/г·экв;
aн - активность ионов водорода в растворе.
Подготовку приборов и определенные значения рН проводят по методикам-инструкциям для конкретного прибора.
Значение рН в жизни рыб чрезвычайно важно. Резкое изменение водородного показателя часто приводит к болезни и гибели рыб из-за расстройства обменных процессов в организме. Поэтому подгонку рН к требуемой величине производят постепенно по 0,3 - 0,5 единицы в сутки, а в приготовленную к нересту воду производителей помещают стадийно, через так называемые промежуточные воды, то есть через смесь воды из их нагульного аквариума и нерестовика. Эту операцию растягивают на 1,5 - 2 часа. Аэрируют промежуточную воду обильно, а аквариумы затемняют во избежание шоков и стрессов.
В стоячих пресноводных водоемах существует связь между жесткостью и кислотностью воды. Так, если вода мягкая, то из-за отсутствия карбонатов кальция, магния и гуминовых кислот она одновременно слабокислая. Если жесткая, то чаще - щелочная.
|
ПОИСК:
|
© Злыгостев Алексей Сергеевич, 2001-2019
При использовании материалов сайта активная ссылка обязательна:
http://aquariumlib.ru/ 'Библиотека по аквариумистике'
При использовании материалов сайта активная ссылка обязательна:
http://aquariumlib.ru/ 'Библиотека по аквариумистике'