
Жесткость воды
Любая пресная или соленая вода из естественных водоемов содержит большее или меньшее количество ионов кальция (Са2+). Это один из самых необходимых элементов для водных ракообразных и моллюсков, использующих его для построения панциря или раковины, а также для рыб, у которых он входит в состав костей. Ионы кальция играют также важную роль в регуляции осмотического давления и многих других процессов в организме. Так, у некоторых рыб содержание Са2+ в крови зависит от степени зрелости половых желез. У самок гольца Salvelinus fontinalis. максимальное содержание этого иона в крови наблюдается в нерестовый период.
Вода нередко содержит также ионы магния Мg2+. Содержащиеся в воде ионы Са2+ и Мg2+ обусловливают жесткость воды. По происхождению различают кальциевую жесткость, обусловленную ионами Са2+, и магниевую, определяемую ионами Мg2+. Общая жесткость определяется суммарным содержанием этих ионов. Жесткость воды в СССР выражают в миллиграмм-эквивалентах ионов Са2+ и Мg2+, содержащихся в 1 л воды. Масса 1 мгокв ионов Са2+ равна 20,04 мг, а 1 мг⋅экв ионов Мg2+ - 12,16 мг. Общая жесткость (Ж) может быть вычислена по формуле
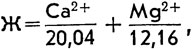
где Са2+ и Мg2+ - концентрация этих ионов в мг/л.
По отношению к процессам смягчения воды жесткость подразделяют на временную (карбонатную) и постоянную (некарбонатную). Карбонатная жесткость обусловлена присутствием гидрокарбонатов кальция и магния. При кипячении гидрокарбонаты разрушаются, а ионы Са2+ или Мg2+ осаждаются в виде малорастворимых карбонатов, например:
Са(НСO3)2 = СаСО3 + Н2O + СO2
Количественно временную жесткость характеризуют содержанием гидрокарбонатов, удаляющихся из воды при ее кипячении в течение часа. Жесткость, сохраняющаяся после кипячения воды, называется постоянной. Она большей частью зависит от содержания кальциевых и магниевых солей серной и соляной кислот.
Приведенная выше единица жесткости (1 мг*экв ионов Са2+ и Мg2+ на 1 л воды), несмотря на свою рациональность, до настоящего времени не получила широкого распространения. Многие аквариумисты по традиции применяют другую единицу - градус жесткости, который в СССР (до введения в 1952 г. новой единицы) измерялся числом граммов СаО в 100 л воды. Русский и немецкий градусы жесткости равны приблизительно 0,357 мг⋅экв/л. Для перехода от градусов жесткости к мг⋅экв/л необходимо число градусов умножить на 0,357. Так, 10° жесткости составляют 3,57 мг⋅экв/л (10⋅0,357). Для обратного перехода - от мг⋅экв/л к градусам жесткости - необходимо число мг⋅экв/л умножить на 2,8: так, 3,57 мг⋅экв/л соответствуют 10° (3,57⋅2,8). Английский градус жесткости равен 0,285 мг⋅экв/л, французский - 0,2 мг⋅экв/л, американский - 0,02 мг⋅экв/л.
В СССР природную воду подразделяют так:
до 1,5 мг⋅экв/л (около 4°) - очень мягкая
1,5-4,0 мг⋅экв/л (4-11°) - мягкая
4-8 мг⋅экв/л (11-22°) - средней жесткости
8-12 мг⋅экв/л (22-34°) - жесткая свыше
12 мг⋅экв/л (более 34°) - очень жесткая
Согласно ГОСТу, жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 мг⋅экв/л (около 20°).
Жесткость природных вод может варьировать в довольно широких пределах. Наибольшей жесткостью отличаются воды морей и океанов. Жесткость речной воды изменяется в течение года и бывает минимальной во время паводка. В табл. 2 приведены значения жесткости воды некоторых рек СССР и Латвийской ССР (в летний период).
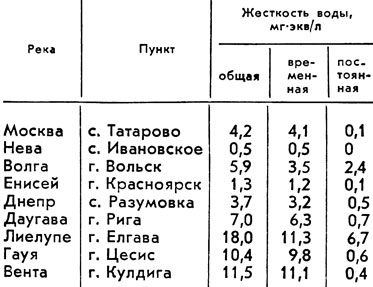
Таблица 2. Жесткость воды некоторых рек СССР и Латвийской ССР
Как видно из таблицы, в основном жесткость воды обусловлена легкоустранимой карбонатной жесткостью. Кроме кипячения известен ряд других химических способов уменьшения жесткости воды, которые, однако, не получили распространения в практике аквариумного рыбоводства. Некоторые практические советы по умягчению воды будут приведены ниже, при описании условий содержания рыб.
Для определения жесткости воды в последнее время широко применяется комплексонометрический метод, значительно более простой и удобный, чем применявшиеся ранее ацидиметрические методы. Титрование производится рабочим раствором комплексона III, или трилона Б, в щелочной среде. Индикатором является эриохром черный T (другое название - хромоген черный специальный ET-00).
|
ПОИСК:
|
© Злыгостев Алексей Сергеевич, 2001-2019
При использовании материалов сайта активная ссылка обязательна:
http://aquariumlib.ru/ 'Библиотека по аквариумистике'
При использовании материалов сайта активная ссылка обязательна:
http://aquariumlib.ru/ 'Библиотека по аквариумистике'